Вільні жирні кислоти: ключ до розуміння інсулінорезистентності
Вільні жирні кислоти: ключ до розуміння інсулінорезистентності
Тема інсулінорезистентності дуже гостра. Більшість хвороб цивілізації, починаючи від депресії, серцево-судинних хвороб до хвороби Альцгеймера пов'язані з обмінними порушеннями. Однак дуже цікаво, який зв'язок існує між способом життя та хворобами, як нутрієнти викликають конкретні порушення обміну речовин. Тому сьогодні я розповім про СЖК – вільні жирні кислоти (на ілюстраціях позначені як FFA – free fatty acids). З одного боку СЖК - це основне джерело енергії, але з іншого боку - це і важлива сигнальна молекула. Особливо хочу зазначити, що коли йдеться про хронічне підвищення СЖК як причину інсулінорезистентності (ІР), то пам'ятайте, що проблема не в СЖК, а в тому, що їм нема куди використовуватися, тому в крові з'являється їх надлишок. Стаття вийшла великою, але кому цікаво зрозуміти логіку здоров'я та хвороби – то ласкаво просимо. Питання лептину та вісцерального жиру окремо викладено у ряді статей.
Вільні жирні кислоти
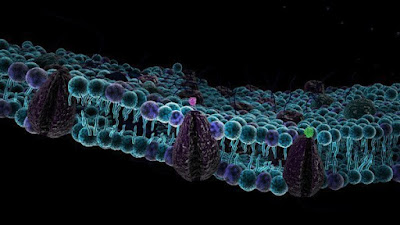
Вільні (або не етерифіковані) жирні кислоти (СЖК) утворюються в результаті гідролізу тригліцеридів, що містяться у жирових тканинах. Плазмові жирні кислоти або етерифіковані і в цьому випадку переважно пов'язані з альбуміном або не етерифіковані і знаходяться у вільному стані. Вільні жирні кислоти (СЖК) входять до складу ліпопротеїнів 5 класу. Останні складаються з довголанцюгових жирних кислот, міцно пов'язаних із двома специфічними ділянками молекули альбуміну; при підвищенні рівня СЖК у плазмі вони займають додаткові ділянки цієї молекули, але зв'язок у цьому випадку виявляється менш міцним. СЖК є головним енергетичним субстратом організму. Вони утворюються в процесі ліполізу тригліцеридів, накопичених у клітинах жирової тканини. Тканинна ліпаза в цих клітинах знаходиться під нейроендокринним контролем, та її активація здійснюється через аденілатциклазну систему.
Другим джерелом СЖК плазми є гідроліз тригліцеридів, що містяться в ліпопротеїнах, під впливом ліпопротеїнової ліпази. Здатність скелетних м'язів (та інших тканин) підлаштовувати свій метаболізм до субстрату, що домінує в даний момент, прийнято називати «хорошим метаболічним здоров'ям» або «метаболічною гнучкістю». Зрозуміло, що хороше «метаболічне здоров'я» пов'язане із нормальною чутливістю до інсуліну. Здатність скелетних м'язів (та інших тканин) підлаштовувати свій метаболізм до субстрату, що домінує в даний момент, прийнято називати «хорошим метаболічним здоров'ям» або «метаболічною гнучкістю». Зрозуміло, що хороше «метаболічне здоров'я» пов'язане із нормальною чутливістю до інсуліну. Здатність скелетних м'язів (та інших тканин) підлаштовувати свій метаболізм до субстрату, що домінує в даний момент, прийнято називати «хорошим метаболічним здоров'ям» або «метаболічною гнучкістю». Зрозуміло, що хороше «метаболічне здоров'я» пов'язане із нормальною чутливістю до інсуліну.
Обмін вільних жирних кислот
Період напівжиття СЖК дуже нетривалий – 4 – 8 хв, і вони легко поглинаються з плазми м'язовими клітинами організму. Другий шлях їх обміну полягає в поглинанні печінкою та ресинтезі в тригліцериди, які потім можуть транспортуватися з печінки у складі ЛПДНЩ або окислюватися до ацетил-СОА. У фізіологічних умовах рівень СЖК у крові може підвищуватися та знижуватися дуже швидко, задовольняючи потребу організму у цій формі енергії.
Їх вміст зазвичай нижчий після всмоктування вуглеводів і викиду інсуліну, що виникає внаслідок цього, але в міру зниження рівня глюкози в крові після їжі їх рівень підвищується. Натщесерце у крові міститься, зазвичай, 400 — 600 мкэкв/л СЖК; при більш тривалому голодуванні (до 24 - 72 год) рівень СЖК може досягати 1000 - 1500 мкекв/л. Глюкагон, адреналін, гормон росту та АКТГ також підвищують рівень СЖК. Головними фізіологічними регуляторами вмісту СЖК у плазмі є інсулін і адреналін.
Щохвилини утилізується 20-40% СЖК, що потрапляють у плазму, - вони окислюються, реетерифікуються або перетворюються на інші жирні кислоти. Під час спокою окислення відбувається, в основному, в печінці і в серці, а при навантаженнях - в скелетних м'язах, причому в останньому випадку частка окислюваних СЖК зростає приблизно від 20 до 60%.
Більшість СЖК, захоплених клітинами печінки, реетерифікується з утворенням головним чином тригліцеридів, а також фосфоліпідів, для синтезу яких використовується, як правило, лінолева кислота. У плазмі СЖК виявляються в діапазоні концентрацій від 100 мкмоль/л до 1 ммоль/л та їх рівень залежить від часу доби. Після кожного прийому їжі рівень СЖК у плазмі падає, тому що інсулін пригнічує в жирових клітинах ліполіз, у результаті якого утворюються СЖК. У нічний час концентрація СЖК у плазмі зростає. До цих нормальних добових коливань рівнів СЖК «підлаштовуються» майже всі інші тканини, зокрема скелетні м'язи, які «перемикаються» з утилізації глюкози (вдень) на споживання СЖК (вночі).
Деякі причини порушення обміну СЖК
Ключове порушення обміну вільних жирних кислот – це їхнє хронічне підвищення. Хронічне повішення рівня СЖК може бути викликано безліччю причин харчового та стресового типу. Наприклад, надлишок вуглеводів, при якому починається синтез нових жирних кислот з надлишку вуглеводів. Оскільки у здорової людини 75-80% глюкози утилізується скелетною мускулатурою, то фізична активність робітників важкої праці може запобігти розвитку «функціональної» резистентності до інсуліну. Недолік фізичної активності також спричинює підвищення СЖК.
Хронічний стрес будь-якого типу – ще одна причина хронічного підвищення СЖК. Під час стресу в крові підвищується рівень СЖК для забезпечення роботи серця та м'язів. Але людина зазвичай не рухається і всі ці жирні кислоти циркулюють у крові тривалий час. У широкомасштабних дослідженнях виявлено зворотну залежність між становищем людини на соціально-економічних сходах та ймовірністю розвитку метаболічного синдрому. Робиться висновок, що розвиток метаболічного синдрому – біологічний механізм, що веде до «соціальної нерівності у розподілі коронарного ризику серед людей». Високі коронарні ризики (підвищений рівень тригліцеридів та низький рівень холестерину-ліпопротеїдів високої щільності) пов'язані з низьким соціально-економічним статусом («бідним дитинством»), що у зрілі роки призводить до надмірної ваги та ожиріння.
СЖК – і метаболіт, і сигнальна молекула
Численні дослідження останніх років показали, що, по-перше, СЖК – це високоенергетичне паливо, а й важливі сигнальні молекули. Їхня концентрація – важливий регуляторний фактор, що впливає на інтенсивність утилізації глюкози в м'язах. І, друге, адипозні тканини – це ще й найважливіший ендокринний орган, який секретує велику кількість факторів, названих адипоцитокінами, які мають або сенсибілізуючий вплив на інсулін (це адипонектин та лептин), зокрема, фактора некрозу пухлин – альфа (ФНП-альфа) , резистин та ін.
При надмірній кількості адипозних тканин відбувається їх надлишковий ліполіз. У нормі вивільнення СЖК з адипозних тканин суворо регулюється, що забезпечує інші тканини чітко збалансованою кількістю СЖК, необхідним адекватного задоволення їх енергетичних потреб. Але при ожирінні в кров надходять, таким чином, патологічно підвищені кількості сигнальних молекул (особливо, ФНП-альфа), що веде до порушення метаболічного гомеостазу. Таким чином, ранні події, що призводять до порушення механізму дії інсуліну та виникнення ІР, відбуваються саме в адипозних клітинах і задовго до виникнення порушеної толерантності до глюкози.
Профіль вільних жирних кислот у сироватці змінюється залежно від статі та віку, режиму харчування, зміни гормонального статусу; наприклад, адреналектомія або кастрація призводять до зміни профілю РК. Зміна концентрації вільних РК у свою чергу призводить до значних змін на двох стадіях перенесення гормональної інформації: зв'язування глюкокортикоїдів з їх специфічними білками-носіями в плазмі та тканинними рецепторами.
З сучасних позицій вільні жирні кислоти більше не розглядаються як пасивні субстрати, залучені до метаболічних процесів. Вільні жирні кислоти – це важливі метаболічні сигнали та учасники ліпідних порушень. У низці ситуацій вони поводяться як гормоноподібні молекули, впливаючи на транскрипцію генів, зв'язуючись із низкою рецепторів. Серед рецепторів, що зв'язуються зі СЖК/FFA або їх дериватами, особливе місце посідають пероксисом проліфератор-активовані рецептори – PPARs. Також сполучений з G-білком рецептор GPR120, який у великій кількості експресується в кишечнику, функціонує як рецептор для ненасичених довголанцюгових вільних жирних кислот FFA. Стимуляція GPR120 вільними жирними кислотами сприяє секреції GLP-1 та підвищує кількість циркулюючого інсуліну.
Вільні жирні кислоти та здоров'я
У зарубіжній медичній літературі вільні жирні кислоти (СЖК) або неестерифіковані жирні кислоти, які утворюються в результаті гідролізу три-гліцеридів, що містяться в адипозних тканинах, називають червоною лампочкою на дошці міокарда. Підвищення їх плазмових рівнів сигналізує про зростаючу небезпеку: спочатку про метаболічний синдром, потім про інсулінорезистентність, діабетичну кардіоміопатію, а далі – ішемічну хворобу серця. Далі ця лампочка може перегоріти, і спалахнуть "лампочки" маркерів некрозу міокарда, що свідчать, що "точка неповернення" пройдено. Отже, підвищені рівні СЖК безпосередньо пов'язані з ожирінням, тобто. «ці лампочки починають світитися задовго до розвитку кінцевої точки», що уможливлює ефективне проведення заходів, що коригують.
Численні результати недавніх досліджень чітко вказують: підвищені рівні СЖК, спричинені надмірною кількістю жирової тканини – якщо не перша, то принаймні одна з головних причин виникнення ІР. Багаторазово і достовірно показано, що більшість пацієнтів, які страждають на ожиріння, метаболічний синдром і цукровий діабет другого типу (ЦД 2), мають підвищені рівні СЖК, що призводить до ІР багатьох тканин – жирової, м'язових, печінки, а також ендотеліальних клітин.
СЖК – незалежний предиктор порушення толерантності до глюкози та ЦД 2 . Отже, підвищений потік СЖК з великої маси адипозних клітин, а також порушення в механізмах, зберігання тригліцеридів і в механізмах ліполізу в тканинах, які нормально чутливі до інсуліну – це, схоже, ранні прояви аномалій, що призводять до ІР. Принципово, що ці порушення виявляються ще до розвитку постпрандіальної гіперглікемії або до розвитку гіперглікемії натще. Справді, підвищення натще плазмових рівнів СЖК, мабуть, раніше вказівка на майбутнє порушення толерантності до глюкози.
Сходи ісулінорезистентності
Крок перший: порушення лептинової регуляції (лептинорезистентність).
У розподілі жирних кислот в організмі людини беруть участь переважно два гормони: гормон росту, який контролює мобілізацію жирних кислот із жирової тканини, та лептин, який контролює β-окислення жирних кислот у мітохондріях.
Однією з важливих функцій лептину є утримання тригліцеридів в адипоцитах. Нормальний рівень лептину захищає інші органи від накопичення жиру (судини, печінка, м'язи та ін.). Лептин активує карнітин-пальмітоїл-трансферу зу-1, яка пов'язує жирну кислоту з карнітином, а останній переносить її через мембрану мітохондрій, і цей процес суворо регулюється. Лептин також стимулює окислення жирних кислот та зменшує кількість триацилгліцеровів у м'язовій тканині. Також встановлено, що лептин пригнічує активність ацетил-КоА-карбоксилази!
Хронічні стреси, переїдання, недоїдання, надлишок цукру, гіподинамія призводять до порушення роботи лептинової системи. Якщо виникає резистентність до лептину, це призводить до збільшення кількості вільних жирних кислот. Настає другий крок – хронічне підвищення СЖК.
Крок другий: збільшення вісцеральної жирової тканини.
Саме вісцеральна жирова тканина буде найпотужнішим джерелом СЖК. Вісцеральний жир збільшується пропорційно до індексу маси тіла і є незалежним предиктором розвитку цукрового діабету 2 типу. Вісцеральна жирова тканина - це основне джерело вільних жирних кислот (СЖК).
При вісцеральному ожирінні в печінку через систему ворітної вени надходить надмірна (в 20-30 разів перевищує норму) кількість вільних жирних кислот, що піддає печінку серйозним навантаженням і, в результаті, призводить до розвитку зазначених вище метаболічних порушень.
Вісцеральний жир, присутній навколо внутрішніх органів, брижі та сальнику, відрізняється від підшкірного типу адипоцитів, їх ендокринної функції, ліполітичної активності, чутливості до інсуліну та інших гормонів. На відміну від підшкірної жирової тканини, венозна кров, що відтікає від вісцерального жиру, через портальну систему безпосередньо надходить у печінку. Це обумовлює безпосереднє надходження до печінки великої кількості вільних жирних кислот (СЖК) та адипокінів, що синтезуються у вісцеральній жировій тканині. Адіпокіни, у свою чергу, активують печінкові імунні механізми, що ведуть до утворення прозапальних медіаторів, таких як С-реактивний білок (СРЛ) та інші. Вільні жирні кислоти, що у великій кількості надходять до печінки з вісцеральної жирової тканини, зумовлюють розвиток печінкової інсулінорезистентності.
Секретуючи моноцитарний хемоаттрактантний протеїн-1 (MCP-1), що сприяє макрофагальній інфільтрації жирової тканини, адипоцити зумовлюють прозапальний стан. Макрофаги, у свою чергу, є важливим джерелом прозапальних цитокінів, таких як фактор некрозу пухлин-α (ФНП-α) та інтерлейкін-6 (ІЛ-6). Вісцеральна жирова тканина відрізняється більшою інфільтрацією запальними клітинами, і тому секретує велику кількість прозапальних цитокінів у порівнянні з підшкірним жиром.
Ектопічний жир – тобто. жир, який знаходиться не в підшкірно-жировій клітковині. Цей жир найчастіше вісцеральний, або печінковий, або міжм'язовий. Але його об'єднує те, що це не підшкірний жир, а «неправильне» місце. Подальший розвиток хвороби залежатиме від того, в яких саме тканинах, не призначених для їх зберігання, накопичуватимуться СЖК. Якщо вони накопичуються у скелетних м'язах – це призведе до ІР, якщо у печінці – до дисліпідемії. Спочатку, як правило, розвивається ІР, потім, з її обтяженням – ішемічна хвороба серця – ІХС.
Крок третій: хронічне підвищення СЖК.
Як було показано вище, при вісцеральному ожирінні в печінку через систему ворітної вени надходить надмірна (в 20-30 разів перевищує норму) кількість вільних жирних кислот, що піддає печінку серйозним навантаженням і, в результаті, призводить до розвитку зазначених вище метаболічних порушень. У крові з'являється підвищений хронічний рівень СЖК. Разом із лептинорезистентністю це поступово призводить до збільшення кількості жиру у нежирових органах.
Під дією СЖК у жировій тканині утворюються більші адипоцити, резистентні до дії інсуліну, ініціюється процес місцевого запалення, збільшується секреція прозапальних цитокінів.
Хронічне підвищення рівня жирних кислот у крові є наслідком порушення в організмі системи регулювання їхнього гомеостазу. Резистентність до лептину, мабуть, не допускає перевищення якогось його стаціонарного краю окислення і, отже, утилізації надлишкової кількості жирних кислот у мітохондріях. Тому, як можна припустити, виникає ситуація, коли внаслідок підвищеного вмісту жирних кислот у навколоклітинному просторі їх потік у клітину посилюється (через підвищення вмісту жирних кислот в організмі через їх недовитрати), а при одночасної резистентності до лептину окиснення жирних кислот залишається на колишньому рівні.
Можливо, зворотний зв'язок між надходженням жирних кислот у клітину нежирової тканини та його секрецією в кров або порушується, або вона взагалі немає, тобто. відсутній механізм підтримки стаціонарного рівня жирних кислот у крові. Якщо таке припущення правильне, то цьому плані регуляція метаболізму жирних кислот принципово відрізняється від регуляції обміну глюкози, стаціонарний рівень якої підтримується системою гормонів.
Під контролем перебуває, мабуть, лише окислення жирних кислот у мітохондріях, тобто. внутрішньоклітинна утилізація цього енергетичного субстрату. В останні роки досліджуються механізми регулювання потоку жирних кислот в організмі. Було відкрито сімейство ядерних рецепторів PPAR, вони стали відомі через здатність індукувати проліферацію пероксисом і канцерогенез у печінці у відповідь на вплив ксенобіотиків. Відкрито три ізоформи PPAR - α, γ і δ, і найбільш вивчені властивості рецепторов PPARα і PPARγ. Лігандами для рецепторів служать насичені, ненасичені та мононенасичені жирні кислоти.
PPARγ експресується в адипоцитах та знижує секрецію жирних кислот у кров із жирової тканини. PPARα експресується в клітинах печінки, скелетного та серцевого м'язів і діє як «ліпостат», регулюючи процеси внутрішньоклітинного синтезу та β-окислення жирних кислот у мітохондріях та пероксисомах. PPAR стимулюються лептином, гормоном росту та інсуліном, їх експресія підпорядковується циркадному ритму, вони експресуються у відповідь на їжу. Ці рецептори здійснюють внутрішньоклітинну регуляцію жирних кислот, підтримуючи стаціонарний рівень споживання енергії клітиною, але вони, мабуть, не беруть участь у підтримці гомеостазу жирних кислот на рівні організму.
Крок четвертий: виникнення інсулінорезистентності.
Підвищений рівень СЖК призводить до накопичення їх у клітинах, перебудови клітинних мембран та зниження інсулінорезистентності. Надлишок тригліцеридів у клітинах викликає збільшення синтезу запальних цитокінів. Саме жирові тканини в даний момент розглядаються як місце початкового виникнення та розвитку ІР. Це відбувається через: а) надходження в кровотік підвищених рівнів СЖК; 2) підвищеної секреції адипоцитокінів.
Велика маса адипоцитів синтезує підвищені кількості прозапальних цитокінів, що призводить до хронічного запального процесу, який: а) порушує шлях передачі інсулінового сигналу і б) ушкоджує функції мітохондрій, що порушує гомеостаз глюкози. Зокрема, секретовані жировими клітинами ІЛ-6 і ФНП-альфа обтяжують ІР, а ангіотензин II, що секретується, підвищує артеріальний тиск і сприяє розвитку атеросклерозу.
Порушення пристосувального механізму
У клітині з жирних кислот, не витрачених на β-окислення, спочатку синтезуються фосфоліпіди, а потім тригліцериди, які акумулюються у цитоплазмі. Внутрішньоклітинні тригліцериди в нежирових тканинах містять переважно пальмітинову кислоту. З пальмітинової кислоти синтезується сфінгомієлін, який є основним компонентом мембранних рафтів, що беруть участь у регуляції активності мембранних рецепторів.
Синтез сфінгомієліну, який залежить від вмісту в клітині пальмітинової кислоти, здійснюється шляхом «пальмітинова кислота → церамід → сфінгомієлін». Саме шлях синтезу цераміду із пальмітинової кислоти призводить до оксидативного апоптозу. Церамид є індуктором апоптозу як окислювальним шляхом (церамід блокує комплекс III ЕТЦ, викликаючи посилену генерацію оксидантів), так і без залучення мітохондрій. Накопичення тригліцеридів у кардіоміоцитах асоційовано зі зниженням синтезу кардіоліпіну та зміною дихальної функції мітохондрій, оскільки цитохром з оксидаза комплексу IV ЕТС пов'язана з кардіоліпіном. Зміна структури мембрани мітохондрій призводить до вивільнення цитохрому з та до апоптозу без участі оксидантів. Таким чином,
У зв'язку з цим акумуляцію в клітинах тригліцеридів (самі тригліцериди не індукують апоптоз) розглядають як спробу організму уникнути ефекту ліпотоксичності.
Сфінгомієлін та пальмітинова кислота виявляють високу афінність до холестерину. Збільшенням вмісту сфінгомієліну та пальмітинової кислоти в мембрані можна пояснити асоційоване з віком накопичення в мембранах холестерину, а також зміну чутливості інсулінового рецептора.
Інсуліновий рецептор пов'язаний з мембранними рафтами і зміна складу рафтів впливає на його чутливість. Акумуляція тригліцеридів у нежирових тканинах і пов'язане з цим зниження чутливості рецептора інсулінового веде до виникнення резистентності до інсуліну і гіперглікімії, тобто. до підвищеного вмісту глюкози у крові. Рецептор до інсуліну є тирозинкіназою.
За допомогою аутофосфорилювання активуються різні шляхи, зокрема шлях PI-3-K (фосфоінозитол-3-кеназа), за рахунок якого і відбувається транспорт глюкози всередину клітини, так як приходить у свій активний робочий стан транспортер глюкози GLUT4. За рахунок активного ліполізу вільних жирних кислот (СЖК) та прозапальних цитокінів, вони впливають на субстрати інсулінового рецептора і тим самим блокується шлях PI-3-K, внаслідок чого блокуються ефекти, які чинить цей шлях на обмін глюкози, і глюкоза не може увійти до клітки. У такий спосіб розвивається інсулінорезистентність, тобто. надмірна кількість вісцеральної жирової тканини блокує інсуліновий сигнал і призводить до того, що інсулінові рецептори стають нечутливими до інсуліну, і його біологічна роль перекручується.
Залежно від індивідуальної чутливості та генетики інсулінорезистентність може розвиватися в різних тканинах. Надлишок СЖК опосередковує прогресування інсулінорезистентності багатьох тканин — м'язової, у тому числі міокардіальної, печінкової, адипозної, а також ендотеліальних клітин, сприяє прогресуванню ішемічних змін у міокарді, у тому числі змін, пов'язаних з порушенням бета-окислення СЖК.
Крок п'ятий: печінкова та м'язова інсулінорезистентність.
В умовах підвищеного надходження в організм їжі, багатої жирами та вуглеводами, стимулюється секреція інсуліну, який, у свою чергу, активує ліпогенез та відкладення СЖК у жировій тканині. Однак є генетично-детермінована межа здатності накопичувати ліпіди, тому коли обсяг жирової тканини досягає максимуму, надлишок СЖК починає надходити в печінку і м'язи.
Надлишок СЖК супроводжується накопиченням тригліцеридів у паренхімальних клітинах багатьох тканин, а саме в скелетних та кардіальних міоцитах та в гепатоцитах, що веде до їх пошкодження та хронічної дисфункції.
В результаті печінка в умовах інсулінової резистентності починає активно синтезувати жирні кислоти, тригліцериди, прискорюється ліполіз, але вже в жировій тканині. Крім того, у печінці відбуваються всі ті процеси, які призводять пацієнта з вісцеральним ожирінням до цукрового діабету: стимулюється глюконеогенез та пригнічується гліколіз та синтез глікогену.
З'ясовано досить складну схему, яка відображає, що інсулінова резистентність, або резистентність до інсуліну, призводить до того, що печінка у нас стає перевантаженою жирними кислотами. Це за рахунок того, що синтезуються активні жирні кислоти в печінці, знижується окислення жирних кислот, активно йдуть жирні кислоти в печінку з вісцеральної жирової тканини і, крім того, жир, який у складі хіломікронів потрапляє до нас у печінку, також перевантажує печінку вільними жирними кислотами.
Дані процеси призводять до того, що печінка не в змозі метаболізувати шляхом β-окислення СЖК, включається перекисне окислення ліпідів, в результаті чого у великій кількості продукуються активні форми кисню, виникає оксидативний стрес, і саме ці фактори призводять до фосфорилування субстрату інсулінового рецептора що ми говорили попередньому слайді, цим, знову запускається резистентність до інсуліну, тобто. виникає своєрідне хибне коло, і вже визначити у пацієнта, що первинне, досить складно. Крім того, доведено, що макрофаги вісцеральної жирової тканини мають прозапальну активність. Також у жировій тканині знайдено і CD-8 + Т-лімфоцити, які активно виділяють прозапальні цитокіни і, тим самим,
М'язова інсулінорезистентність
Незабаром після печінки жир починає накопичуватися в м'язах. Характерна для ІР метаболічна патологія – накопичення довкола м'язових фібрил тригліцеридів. Однак накопичення тригліцеридів усередині скелетних м'язів, як вважається, не є безпосередньою причиною розвитку ЦД 2, але, схоже. може бути маркером інтермедіатів ліпідів. таких, як ацетил КоА, цераміди та діацилгліцерин
Згідно з нещодавніми дослідженнями, порушення шляху передачі інсулінового сигналу пов'язане, в основному, з патологічним метаболізмом СЖК у клітинах скелетних м'язів, які «не справляються» з їхньою утилізацією, коли СЖК у надлишку. Справді, локальне накопичення всередині скелетних м'язів таких метаболітів СЖК, як цераміди, діагліцерол або ацил-КоА, веде до порушення передачі інсулінового сигналу і, тим самим, до порушення транспорту глюкози.
Крок шостий. Порочне коло інсулінорезистентності.
Інсулінорезистентність, спричинена високим рівнем СЖК, ще більше підвищує концентрацію СЖК у плазмі. Як виявилось, інсулінорезистентні жирові клітини секретують підвищені рівні СЖК. Це, власне, і дозволяє вважати підвищені рівні СЖК маркером ІР. Дійсно, при ІР рівень СЖК у гепатоцитах підвищується, тому що в них:
1) підвищується ліпогенез de novo,
2) етерифікація СЖК перевищує їх окислення,
3) етерифіковані РК запасаються у вигляді тригліцеридів або спрямовуються на синтез Х-ЛПОНП (багатих на тригліцериди),
4) знижується регульована інсуліном мобілізація тригліцеридів.
Інсулінорезистентні адипоцити інтенсивно розщеплюють тригліцериди, що містяться в них, і вивільняють СЖК, що утворилися з них, в кровотік (як при ожирінні, так і без нього). Потік СЖК з жирових клітин підвищується і, більше того, СЖК також виходять з Х-ЛПОНП та з хіломікронів плазми та по кровотоку частково направляються в інші органи, а частково – назад у печінку, де знову перетворюються на тригліцериди. Відбувається «накачування» печінки СЖК та тригліцеридами. Це має найтяжчі наслідки.
Крок сьомий. Прискорення атеросклерозу.
Підвищені рівні СЖК призводять до дисліпідемії та атерогенезу.
Як інсулінорезистентність веде до дисліпідемії Підвищення у печінці тригліцеридів стимулює утворення Апо В та Х-ЛПОНП,
Ось як це відбувається.
1) З печінки високі рівні Х-ЛПОНП секретуються в плазму, де через ліполіз з Х-ЛПОНП утворюються СЖК і високоатерогенні ремнантні (залишкові) частинки ліпопротеїнів, багатих на тригліцериди.
2) З плазми СЖК та ремнантні частинки знову поглинаються печінкою, що ще більше підвищує рівень СЖК у гепатоцитах та ще більше стимулює синтез Х-ЛПОНП.
3) У печінці, при високому рівні Х-ЛПДНЩ і нормальному рівні білка CETP (cholesteryl ester transfer protein) – переносника ефіру холестерину, тригліцериди з Х-ЛПДНЩ переходять у Х-ЛПВЩ, а холестерин з Х-ЛПВЩ переходить у Х-ЛПВЩ. У результаті утворюються: а) багаті холестерином дуже атерогенні ремнантні частки Х-ЛПДНЩ і б) Х-ЛПЗЩ, що містить багато тригліцеридів і мало холестерину.
4) Такі частинки Х-ЛПЗЩ втрачають тригліцериди (під дією печінкової ліпази) та свій основний аполіпопротеїн Апо А1. Через війну рівень антитерогенного Х-ЛПВП знижується.
5) При високому рівні Х-ЛПОНП (багатих на тригліцериди), CETP переносить тригліцериди з Х-ЛПОНП до Х-ЛПНГ, а холестерин – з Х-ЛПНП до Х-ЛПОНП.
6) Багаті тригліцеридами Х-ЛПНГ через активність печінкової або ліпопротеїнової ліпази втрачають тригліцериди, зменшуються в розмірах і стають дуже атерогенними дрібними щільними частинками Х-ЛПНЩ.
Таким чином, підвищені рівні СЖК призводять до зниження рівня «антиатерогенного» Х-ЛПВЩ, утворення вкрай атерогенних дрібних щільних частинок Х-ЛПНЩ та підвищення плазмових рівнів тригліцеридів (19).
Але є ще один шлях, яким високі рівні СЖК спричинюють атерогенез. Цей шлях більш прямий та короткий. Підвищений при ІР рівень СЖК викликає в мітохондріях макросудинних ендотеліальних клітин надсинтез активних форм кисню, що веде до окислення Х-ЛПНГ та модифікації Х-ЛПВЩ. Це індукує запальний процес у стінках судин, утворення та накопичення бляшок холестерину і, в результаті – ішемію.